Le cisplatine est l'agent chimio-thérapeutique le plus largement utilisé pour le traitement de la majorité des tumeurs solides, et la résistance des cellules néoplasiques à ce composé cytotoxique pose un problème majeur en oncologie clinique.
Dans cette étude, le cisplatine a été amené à réagir en solution avec le dipeptide cystéinyl-glycine (CysGly), choisi comme modèle fonctionnel du glutathion, et les produits de réaction ont été analysés par spectrométrie de masse à ionisation par électrospray (ESI-MS). Des complexes sélectionnés ont été soumis à une spectroscopie IR de dissociation de photons multiples (IRMPD) pour obtenir leurs caractéristiques vibratoires. Les spectres d'ions IR expérimentaux ont été comparés aux absorptions IR calculées de différentes familles d'isomères plausibles, révélant que CysGly se lie préférentiellement au platine (II) via son groupe thiolique déprotoné dans le complexe monovalent cis-[PtCl(NH3)2(CysGly)]+ , et d'évoluer dans la structure chélate liée au S,N cis-[PtCl(NH3)(CysGly)]+ via les fonctionnalités SH et NH2 du résidu cystéine. De plus, les résultats indiquent que la réaction de platination n’affecte pas la liaison peptidique CysGly, qui reste dans sa configuration trans.
Ces résultats fournissent donc des informations supplémentaires sur la réactivité des complexes de Pt (II) avec le glutathion, impliqué dans la résistance cellulaire au cisplatine.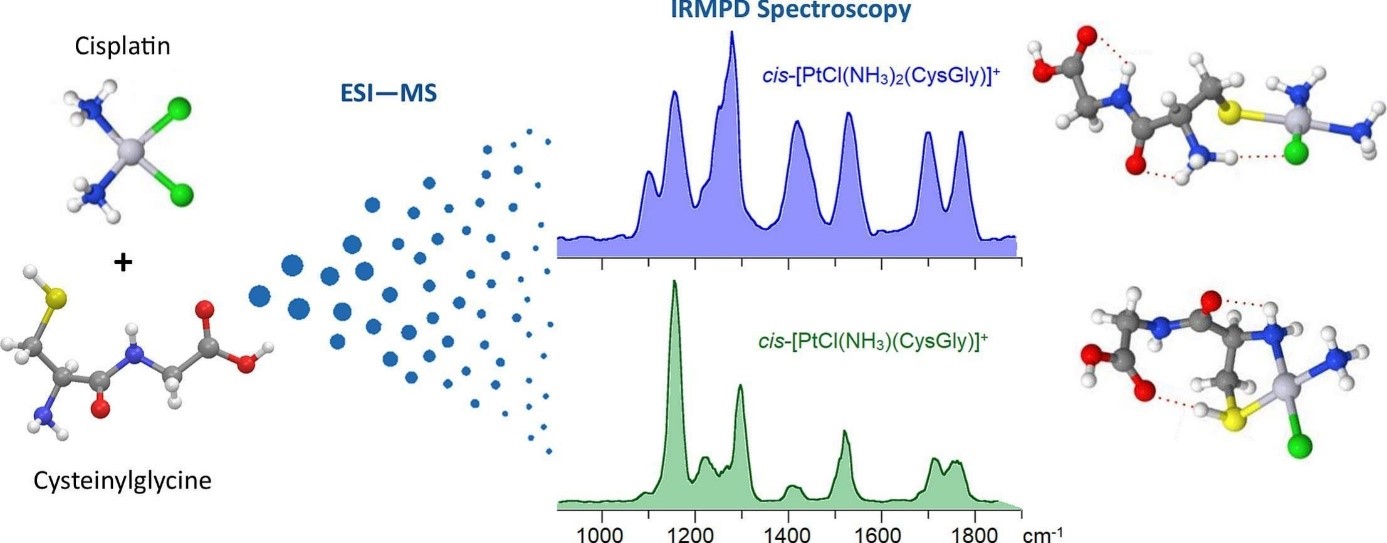
En savoir plus : DOI : 10.1016/j.jinorgbio.2023.112342
Plateforme : FT-ICR, ICP - CNRS/Université Paris Saclay, Orsay
