 Equipe Biophysique des systèmes complexes (BIOSYS) de l'ISA, Lyon
Equipe Biophysique des systèmes complexes (BIOSYS) de l'ISA, Lyon
L'équipe Biosys s'intéresse à la dynamique des protéines et à leurs interactions. Pour cela elle utilise diverses méthodes biophysiques couplées à des simulations de dynamique moléculaire.
Nous avons utilisé les moyens Infranalytics RMN à très hauts champs 900 et 1200 MHz de Lille. Nous avons mis en œuvre une série de mesures de relaxation de spin basée sur l'observation de la relaxation longitudinale et transversale 15N ainsi que des NOEs hétéronucléaires 1H-15N. Ces mesures ont été combinées à celles réalisées à l'aide de nos moyens locaux (400 et 600 MHz). Ces expériences de relaxation de spin permettent d'accéder à la dynamique locale et globale qui caractérise les protéines dans la gamme ps-ns. Cependant, la détermination des paramètres dynamiques tels que paramètres d'ordre (S2), temps de corrélation (tc) ou encore temps de corrélation rapide (tfast) sont obtenus moyennant un certain nombre d'hypothèses. L'une d'entre elle consiste à utiliser une valeur moyenne pour l'anisotropie de déplacement chimique (CSA) plutôt que d'attribuer une valeur unique à chaque 15N. Cette approximation est justifiée pour des champs allant jusqu'à 600 MHz mais peut engendrer un biais significatif dans l'exploitation des données de relaxation à très haut champs.
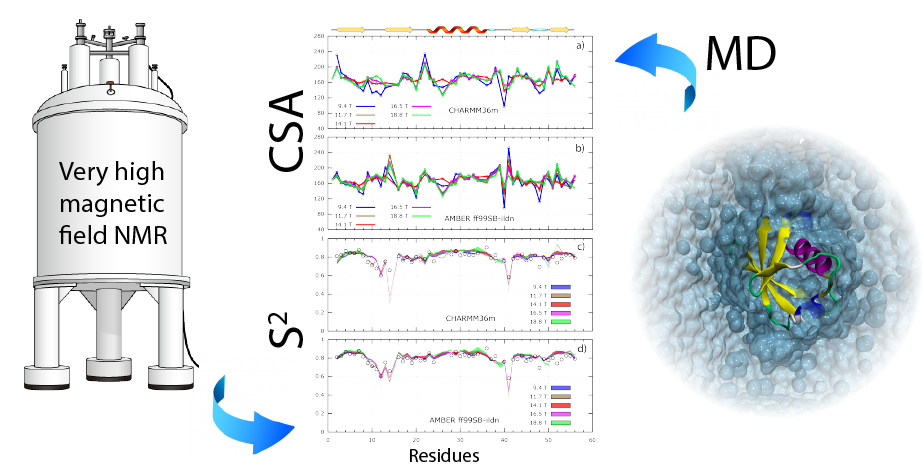 A l'aide d'une protéine modèle telle que l'ubiquitine et en associant les mesures obtenues à quatre champs magnétiques, nous avons déterminé les valeurs de l'anisotropie de déplacement chimique (15N-CSA) pour chaque résidu. L'utilisation d'une valeur uniforme de -160 ppm engendre des fluctuations importantes des valeurs du paramètres d'ordre (S2) en fonction du champ magnétique. A contrario, l'utilisation d'une valeur de CSA propre à chaque résidu réduit considérablement ces fluctuations. Il est alors possible de substituer une série de mesure à plusieurs champs par la combinaison d'une mesure à un champ unique et de simulations de dynamique moléculaire pour obtenir des résultats similaires pour S2.
A l'aide d'une protéine modèle telle que l'ubiquitine et en associant les mesures obtenues à quatre champs magnétiques, nous avons déterminé les valeurs de l'anisotropie de déplacement chimique (15N-CSA) pour chaque résidu. L'utilisation d'une valeur uniforme de -160 ppm engendre des fluctuations importantes des valeurs du paramètres d'ordre (S2) en fonction du champ magnétique. A contrario, l'utilisation d'une valeur de CSA propre à chaque résidu réduit considérablement ces fluctuations. Il est alors possible de substituer une série de mesure à plusieurs champs par la combinaison d'une mesure à un champ unique et de simulations de dynamique moléculaire pour obtenir des résultats similaires pour S2.
En savoir plus : 10.1039/d4cp03821e
Plateforme utilisée : IMEC - ISB - UCCS Lille
