 Béatrice Golinelli-Pimpaneau, UMR 8229 CNRS, Collège de France, Sorbonne Université, Paris
Béatrice Golinelli-Pimpaneau, UMR 8229 CNRS, Collège de France, Sorbonne Université, Paris
Je suis directrice de recherche au CNRS dans le Laboratoire de Chimie des Processus Biologiques au Collège de France. J'utilise la cristallographie aux rayons X, la modélisation moléculaire, la mutagénèse dirigée, la spectrométrie de masse et des techniques de spectroscopie afin de comprendre la catalyse enzymatique au niveau moléculaire.
Une des enzymes que j'étudie, la RNase Y de Bacillus subtilis agit au sein du complexe du dégradosome, pour initier la dégradation de l'ARN messager dans de nombreuses bactéries à Gram positif. Le domaine N-terminal de la RNase Y (Nter-BsRNaseY), interagirait avec divers partenaires protéiques au sein de ce complexe. Des analyses précédentes avaient montré que Nter-BsRNaseY est en équilibre entre deux états, monomérique et dimérique, de forme allongée, avec un contenu élevé d'hélices α. Malheureusement, aucun cristal de ce domaine Nter-BsRNaseY n’a pu être obtenu, empêchant la résolution de sa structure par cristallographie aux rayons X.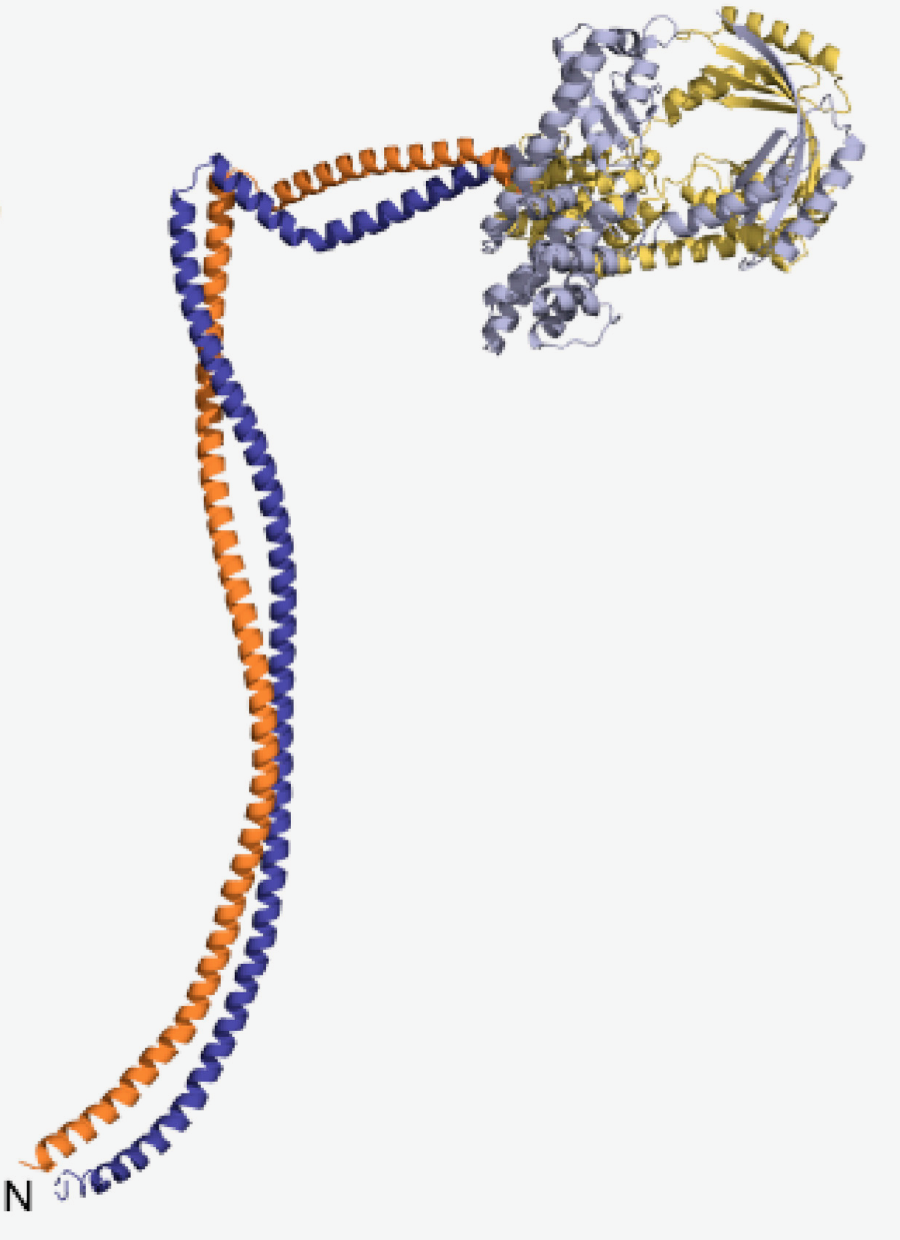
Nous avons donc contacté l’équipe RMN de l’ICSN dans le cadre d’Infranalytics. En utilisant la RMN hétéro-nucléaire multidimensionnelle et les prédictions tridimensionnelles d’AlphaFold, nous avons montré que le dimère Nter-BsRNaseY adopte une structure de type « coiled-coil ». Chaque chaîne constituant le dimère est constituée de deux longues hélices reliées entre elles par un coude. Cette organisation structurale du domaine Nter-BsRNaseY est maintenue dans le modèle AlphaFold de l’enzyme RNase Y entière. Dans ce modèle, le domaine catalytique globulaire, est constitué par deux hélices reliant les modules KH (domaine de liaison à l’ARN) et HD (caractéristique de la superfamille de phosphohydrolases métallo-dépendantes), et par la région C-terminale. Celle-ci, dont la fonction était encore inconnue, est très probablement impliquée dans la dimérisation de la RNase Y. Ce travail illustre à merveille comment la RMN à très haut champ peut répondre à des questions inaccessibles par d’autres techniques bio-structurales.
En savoir plus: https://doi.org/10.3390/biom12121798 .
Plateforme utilisée : ICSN, Gif-sur-Yvette
