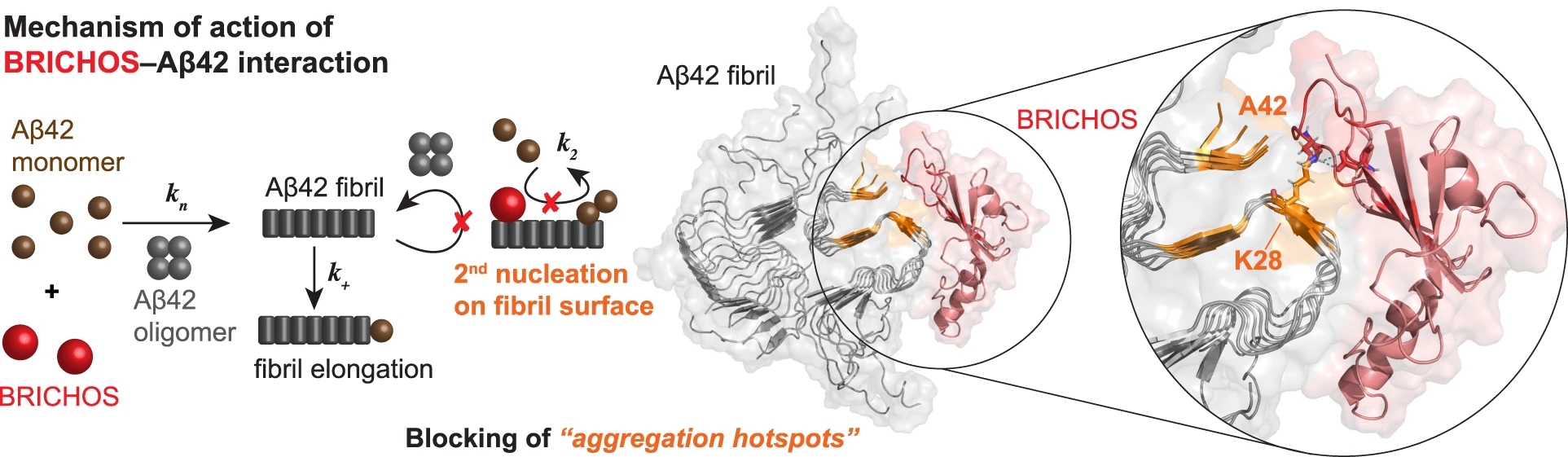
Le mauvais repliement de protéines peut générer des intermédiaires toxiques à l’origine de maladies neurodégénératives telles que la maladie d'Alzheimer. La génération des intermédiaires et des fibrilles amyloïdes du peptide amyloïde-β (Aβ) associés à la maladie d'Alzheimer est catalysée par la surface même de ces fibrilles. Or, il a été démontré que des chaperons moléculaires spécifiquement adaptés, plus spécifiquement le domaine protéique BRICHOS, se lient aux fibrilles amyloïdes et interrompent ce cycle autocatalytique. Dans ce travail de recherche la RMN sous rotation rapide à l’angle magique a permis de caractériser la liaison de BRICHOS à la surface des fibrilles de Aβ42 et donc d’identifier un site potentiel d’agrégation catalytique. Sur la base des résultats RMN, un mécanisme moléculaire est proposé qui permet de comprendre comment les événements de nucléation toxiques peuvent être ciblés par des chaperons moléculaires.
Lien vers la publication : https://doi.org/10.1038/s41467-024-45192-4
Site de la plateforme RMN de Lyon : https://www.crmn-lyon.fr/
