Les antibiotiques perturbent des mécanismes essentiels de la vie cellulaire des bactéries ce qui limite la croissance bactérienne (effet bactériostatique) ou tue les bactéries (effet bactéricide). Cependant, les antibiotiques exercent une pression de sélection naturelle sur les populations bactériennes à l’origine de l’émergence de plus en plus fréquente de bactéries résistantes. Ce problème majeur de santé publique est fortement accentué par la diffusion des antibiotiques et bactéries résistantes dans l’environnement. Cette propagation rapide de la résistance parmi les agents pathogènes bactériens représente un risque sérieux pour l'efficacité et la durabilité des traitements disponibles. En particulier, l’expression d’enzymes appelées β-lactamases est un des facteurs cliniques le plus important pour l’apparition de la résistance chez de nombreuses bactéries, en particulier chez les bactéries à Gram-négatif, mais pas uniquement. Sous la pression des antibiotiques, la production de β-lactamases par les bactéries s'est effectivement répandue, même par les souches qui ne la produisaient pas précédemment grâce au transfert plasmidique d'information génétique entre cellules bactériennes. Ces β-lactamases, qui peuvent être de différents types, dégradent l'anneau des antibiotique β-lactames, le rendant alors inactif. Ces antibiotiques de type β-lactame sont une grande famille connue pour bloquer l’activité des PBPs (Penicillin Binding Proteins) et comprennent entre autres les dérivés de la pénicilline, les céphalosporines, les monobactames et les carbapénèmes.
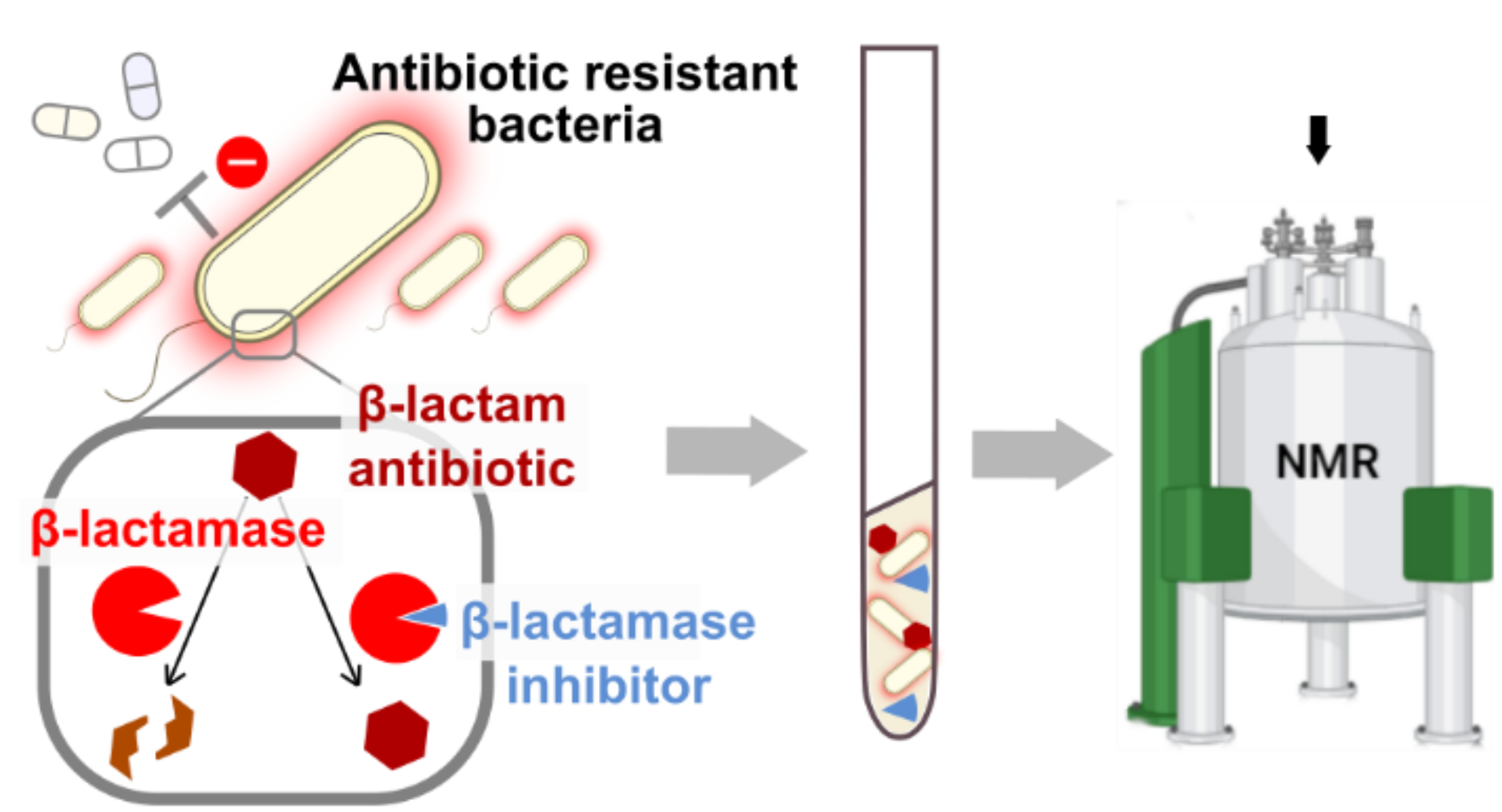
Grace à la RMN appliquée sur des échantillons de bactéries entières, nous démontrons la force analytique de la méthode dans le suivi in situ et en temps réel (i) de l'hydrolyse des β-lactames par les β-lactamases, (ii) de l'interaction des médicaments appartenant à la famille des β-lactames avec leurs cibles essentielles, les PBPs, et (iii) de la liaison des inhibiteurs à ces enzymes. Plus en détail, nous avons optimisé les conditions expérimentales pour enregistrer les spectres RMN d’une des β-lactamases in situ, la carbapénémase KPC-2, ce qui a permis de suivre les perturbations du déplacement chimique, mesurées par RMN et causées par l'interaction de cette β-lactamase avec l'avibactam, l'inhibiteur prototypique de la famille des diazabicyclooctanes. Pour compléter ce travail, nous avons identifié des produits spécifiques du recyclage du peptidoglycane qui s'accumulent en réponse à l'inhibition des enzymes de synthèse du peptidoglycan par les antibiotiques de type β-lactamines et qui agissent en outre comme un signal moléculaire pour l'induction de la β-lactamase chez la plupart des entérobactéries et chez Pseudomonas aeruginosa. Par conséquent, la capacité à surveiller le recyclage du peptidoglycane est un moyen de suivre l'effet des nouveaux antibiotiques sur la physiologie bactérienne et l'apparition de la résistance. Enfin, nous démontrons que notre dispositif expérimental permet de suivre l'activité des β-lactamases sur les β-lactames et de distinguer cette activité de l'inactivation des PBP sans marquage sélectif des β-lactamases ou des PBP.
Plateforme : https://www.ibs.fr/fr/recherche/assemblage-dynamique-et-reactivite/groupe-de-rmn-biomoleculaire/presentation
DOI: 10.1021/jacs.4c00604
