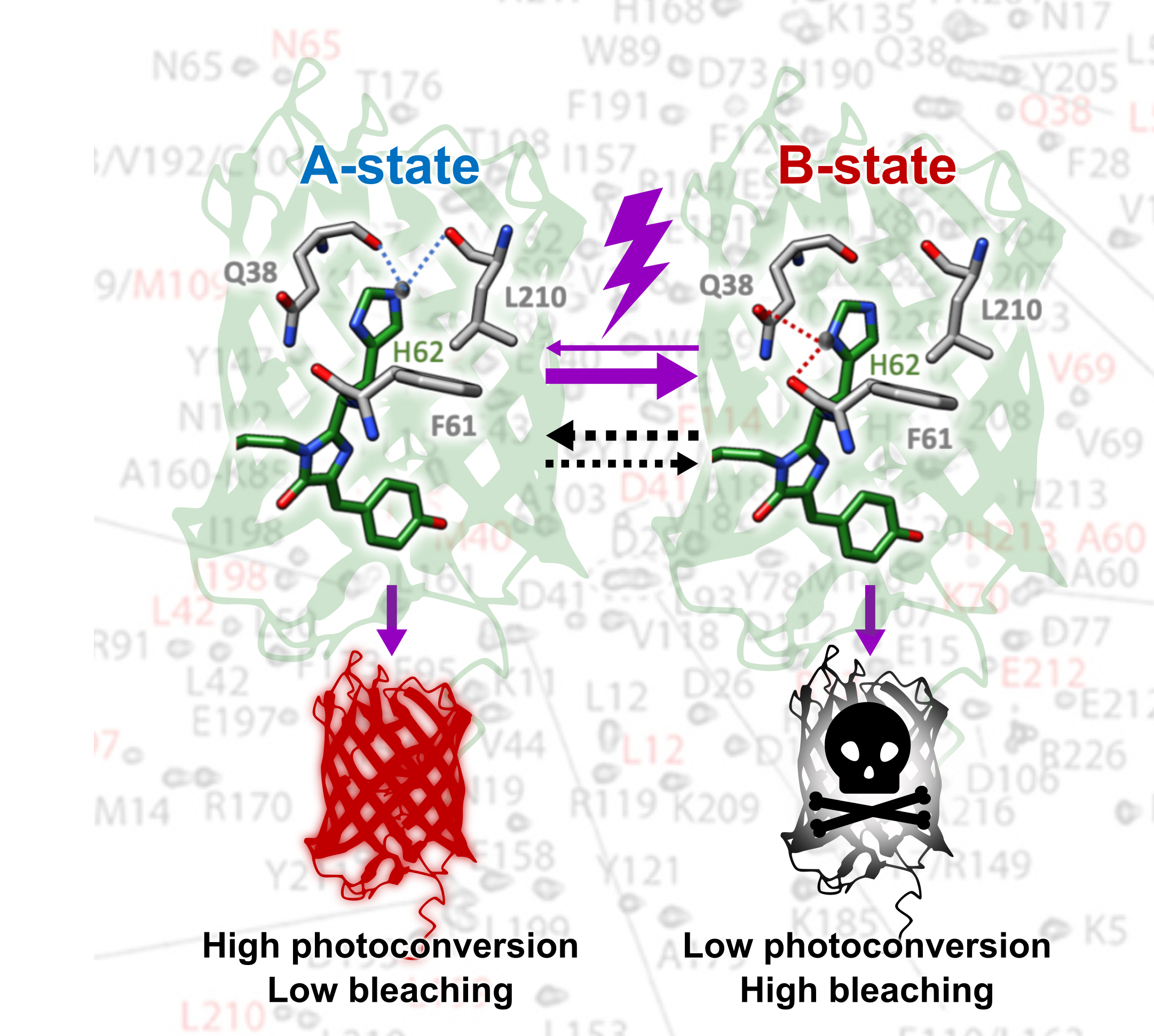
Les protéines fluorescentes photoconvertibles (PCFP) changent leur couleur d'émission de fluorescence du vert au rouge lorsqu'elles sont éclairées par la lumière UV. Elles sont des marqueurs centraux pour les modalités d'imagerie à super-résolution telles que la microscopie de localisation de molécule unique (SMLM) quantitative et à suivi de particule unique. Les propriétés photophysiques de ces protéines sont toutefois extrêmement complexes et une nouvelle étape dans cette complexité a été révélée par une spectroscopie RMN multidimensionnelle avancée combinée à des mesures de fluorescence, en utilisant la protéine mEos4b. Nous avons démontré que la protéine mEos4b, dans son état vert, présente deux conformations qui s'intervertissent lentement dans le temps. Seule l'une de ces conformations se photoconvertit efficacement vers l'état rouge, tandis que l'autre semble plus sensible au photoblanchiment. L'étude permet d'expliquer les comportements photophysiques étranges, observés expérimentalement, de mEos4b et des PCFP apparentées. L'hétérogénéité conformationnelle observée est si subtile qu'elle n'a jamais été détectée par les structures à rayons X à haute résolution de la protéine. Nos résultats révèlent comment la dynamique conformationnelle des protéines fluorescentes peut influencer leur comportement photophysique, aident à comprendre le mécanisme de photoconversion des PCFPs de type mEos4b et ouvrent potentiellement la porte à la conception de nouvelles variantes avec une efficacité de photoconversion supérieure.
Plateforme : https://www.ibs.fr/fr/recherche/assemblage-dynamique-et-reactivite/groupe-de-rmn-biomoleculaire/presentation
DOI: 10.1002/advs.202306272
