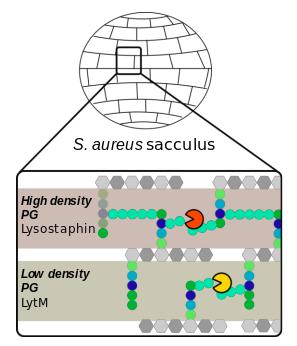
La maintenance de la paroi bactérienne, et en particulier du peptidoglycane base de l'échafaudage des parois cellulaires bactériennes, est une des cibles privilégiées des antibiotiques et la compréhension de sa régulation fine est capitale pour lutter efficacement contre les phénomènes de résistance. L'étude, réalisée en collaboration avec un groupe de microbiologistes polonais, porte sur deux enzymes ayant des structures similaires et une activité lytique élevée contre Staphylococcus aureus, ciblant le pont glycil-glycine des brins peptidiques du polymère formant l'échafaudage des parois cellulaires bactériennes, dont il assure l'intégrité vitale. Grâce à la combinaison de la résonance magnétique nucléaire solide et liquide, associée à la spectrométrie de masse, l'étude dévoile comment la réticulation du peptidoglycane influence directement l'activité, la sélectivité et la spécificité de ces deux enzymes. En effet, les différences entre les modèles obtenus avec les deux enzymes s’accentuent en relation avec la complexité et la réticulation du polymère. Ces résultats mettent en lumière l'interaction complexe entre les enzymes et leurs substrats, ce qui ouvre la voie à des stratégies antibactériennes ciblées.
Plateforme : https://www.ibs.fr/fr/recherche/assemblage-dynamique-et-reactivite/groupe-de-rmn-biomoleculaire/presentation
DOI: 10.1038/s41467-023-42506-w
