Le gène BRCA2 est connu du grand public comme un gène de prédisposition aux cancers du sein et de l’ovaire. Il code pour une protéine (BRCA2) dont le rôle dans la « recombinaison homologue » (RH), nécessaire à la réparation de l’ADN et à la méiose, est largement documenté. BRCA2 sert en particulier à recruter la protéine Rad51 sur l’ADN pour rechercher des homologies de séquence entre deux brins et permettre leur échange. En plus de Rad51, BRCA2 interagit avec d’autres protéines. Une équipe de l’ERASMUS Medical Center (Rotterdam, Pays-Bas) a récemment identifié l’un de ses partenaires, HSF2BP. Cette protéine est largement exprimée dans les cellules en méiose et dans des cellules cancéreuses. Des mutations dans HSF2BP sont impliquées dans des problèmes de fertilité : notamment, la perte de HSF2BP empêche la recombinaison homologue durant la spermatogenèse.
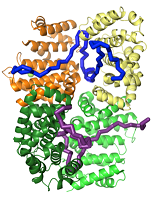
Afin de savoir si HSF2BP est impliqué dans la localisation de BRCA2 à des sites de recombinaison homologue durant la méiose, l’équipe Enveloppe nucléaire, télomères et réparation de l’ADN de l’I2BC en collaboration avec des équipes de l’ERASMUS MC, de l’Université de Salamanca (Espagne) et du Synchrotron SOLEIL (Gif-sur-Yvette), a identifié par RMN le site d’interaction entre BRCA2 et HSF2BP, et a résolu par radiocristallographie la structure du complexe entre ces deux protéines. Elle a ainsi identifié un motif répété dans BRCA2 capable de lier deux domaines d’HSF2BP et montré que deux fragments de BRCA2 se lient simultanément à quatre domaines d’HSF2BP, conduisant à une très forte affinité entre les deux partenaires et à la formation d’un tétramère de domaines d’HSF2BP. La délétion de la première répétition du motif découvert dans BRCA2 diminue fortement l’affinité entre BRCA2 et HFS2BP et empêche la tétramérisation du domaine d’HSF2BP étudié. En revanche, cette délétion ne reproduit pas in vivo (dans un modèle rongeur) le phénotype de perte de HFS2BP. Les auteurs en concluent que l’interaction de forte affinité entre BRCA2 et HFS2BP n’est pas impliquée dans le recrutement de Rad51 aux sites méiotiques de recombinaison homologue. L’ensemble des résultats a été publié dans Nature Communications.