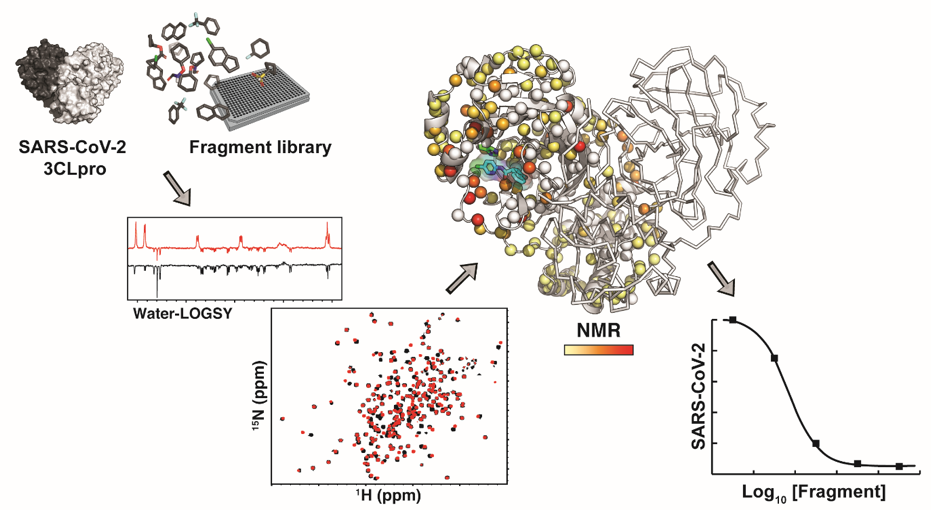
Pour la première fois une analyse par spectroscopie RMN liquide de la protéase dimérique du SRAS-CoV-2 (3CLp) a été réalisée, par les sites RMN de Lille. Cette étude a permis de déterminer que le fragment F01 est un inhibiteur de la protase avec une activité antivirale dans les cellules infectées.
Avec le soutien du projet 3CLPRO-SCREEN-NMR et du site d’infranalytics, des chercheurs et des chercheuses de Lille se sont associés* afin d’étudier la cystéine protéase 3CLpro, enzyme essentielle du SARS-CoV-2 qui coupe les polyprotéines pp1a et pp1ab en unités fonctionnelles. Les résultats obtenus permettent de comprendre les mécanismes de régulation complexes de cette enzyme, laquelle doit s’assembler en dimère pour permettre à son site actif, doué d’une plasticité importante, d’adopter la conformation adéquate pour accueillir le substrat et le couper. Sur la base de ces résultats, les auteurs ont réalisé un criblage de fragments moléculaires par RMN contre la protéase 3CLproa, ce qui a permis d’identifier trois sites de liaison différents, deux au sein du site actif et un à l’interface de dimérisation. De plus, le fragment F01 issu de ce criblage s’est révélé capable d’inhiber l’activité enzymatique de la protéase 3CLpro in vitro et la réplication du SARS-CoV-2 dans des cultures de cellules infectées. Ce fragment F01 devra désormais être optimisé afin d’augmenter son efficacité. Les résultats permettront de mieux comprendre les interactions complexes entre la plasticité du site actif, la dimérisation et l’activité enzymatique de 3CLpro. Ces résultats sont publiés dans Angewandte Chemie International Edition.
* I-Site Université Lille Nord-Europe,l’Institut Pasteur de Lille, laboratoire de Biologie Structurale Intégrative (BSI, CNRS – INSERM/Univ. Lille/Institut Pasteur de Lille/CHU Lille), laboratoire Médicaments et Molécules pour agir sur les Systèmes Vivants (M2SV, INSERM/Institut Pasteur de Lille/ Univ. Lille) et Centre d’Infection et d’Immunité de Lille (CIIL, CNRS/INSERM/Institut Pasteur de Lille/Univ. Lille/CHU Lille).
